Особенности лечения пациентов с наследственными опухолями

В течение последних трех десятилетий с развитием молекулярных технологий продолжается накопление знаний о наследственных факторах, предрасполагающих к развитию опухолей.
Эти знания имеют неоспоримое значение для раннего выявления и профилактики злокачественных опухолей у индивидуумов, подверженных повышенному риску онкопатологии.
Однако, помимо этого, все больше научных данных свидетельствуют о биологической обособленности наследственно обусловленных опухолей от спорадических форм, их отличии как в характере клинического течения, так и в чувствительности к лекарственной терапии [1].
На сегодняшний день 15% всех случаев заболевания злокачественными новообразованиями обусловлены известными наследуемыми мутациями и могут рассматриваться как проявление «наследственных опухолевых синдромов» [2].
При чем, известные генетические факторы объясняют далеко не все случаи с очевидной семейной историей предрасположенности к развитию опухолей.
Таким образом, вероятно, в будущем спектр наследственных «раковых» мутаций будет существенно расширен.
Первые данные об уникальной чувствительности наследственных новообразований к лекарственным препаратам появились в работах середины 80-х годов прошлого столетия, показавших регресс полипов толстой кишки при семейном аденоматозном полипозе на фоне терапии сулиндаком, ингибитором циклооксигеназы2 [3].
В последние годы потенциал индивидуализированных подходов в выборе лекарственной терапии становится очевиден на примере целого ряда наследственных опухолей.
Так, лекарственное воздействие на определенные точки приложения, иногда даже не характерные для спорадических форм тех же опухолей, показало свою эффективность при наследственном раке молочной железы, яичников, поджелудочной железы, щитовидной железы, кожи и др.
Синдром наследственного рака молочной железы и яичников
На сегодняшний день мутации в генах BRCA1 и BRCA2 являются наиболее широко известными и изученными причинными факторами развития наследственных опухолей молочной железы, яичников, а также некоторых других локализаций [4].
Частота носительства данных мутаций в популяции составляет около 0,1%.
Мутации в этих генах несут ответственность за развитие 5-7% опухолей молочной железы, 10-15% опухолей яичников и около 4-7% семейных форм карцином поджелудочной железы [5].
BRCA1 и BRCA2 играют ключевую роль в механизме репарации двухцепочечных разрывов ДНК, называемом гомологичной рекомбинацией (HR, homologous recombination) [6].
Пусковым моментом опухолевой трансформации у носителей мутации является инактивация аллеля гена дикого типа в соматической клетке, в результате чего последняя полностью теряет функциональный белок BRCA1 или BRCA2.
Развивается глубокое нарушение репарации ДНК, приводящее к накоплению хромосомных аберраций и геномной нестабильности, определяющих высоко злокачественный фенотип опухоли.
В то же время нормальные клетки сохраняют один аллель гена дикого типа и адекватную функциональность гомологичной рекомбинации.
Этим определяются существенные различия в толерантности к повреждениям ДНК между нормальными и опухолевыми клетками и формирование широкого терапевтического окна для лечения ДНК-повреждающими агентами [7].
Помимо репарации ДНК BRCA1 играет ключевую роль в дифференцировке ткани молочной железы и в экспрессии рецепторов эстрогенов.
Этим объясняется тот факт, что большинство BRCA1-ассоциированных опухолей молочной железы не экспрессируют рецепторы эстрогенов [8].
В то же время иммунофенотипическое разнообразие BRCA2-ассоциированных опухолей не отличается от спорадических форм [9].
Также BRCA1 участвует в контроле клеточного цикла, запуская процесс апоптоза при повреждении веретена деления [10].
Специфическая чувствительность опухолевых клеток с дефектом BRCA1 или BRCA2 к различным цитостатикам широко изучена в лабораторных экспериментах.
Наиболее убедительно в целом ряде работ показана повышенная чувствительность к препаратам платины и митомицину при дефиците функции этих белков [10, 15].
Очевидно, за репарацию сшивок ДНК, образуемых данными препаратами, несет ответственность механизм гомологичной рекомбинации, и клетки, характеризующиеся дефицитом последней, оказываются нетолерантными к этим цитостатикам.
Противоречивы данные о чувствительности BRCA-дефицитных клеток к доксорубицину, противоопухолевому антибиотику, блокирующему фермент топоизомеразуIIальфа и вызывающему двухцепочечные разрывы ДНК.
В теории, в отсутствие механизма репарации, не приводящего к возникновению ошибок, коим является гомологичная рекомбинация, клетки должны быть более чувствительны к этому цитостатику.
Однако, тогда как в ряде работ показана правомерность данной гипотезы [11,16], в некоторых исследованиях были получены противоположные результаты [15, 17].
Убедительно продемонстрирована сниженная чувствительность BRCA1-дефицитных клеток к таксанам и винкаалкалоидам [10, 17, 18], что объясняется участием белка в запуске клеточной смерти при повреждении микро трубочек веретена деления.
Однако, в некоторых работах получены и противоположные результаты [19].
Кроме того, эффект противомикротрубочковых препаратов оказалcя независимым от функции BRCA2 [20].
Активность алкилирующих агентов достаточно ограниченно исследована на моделях BRCA2-дефицитных клеток.
При фармакологическом скрининге на модели рака молочной железы мышей алкилирующие агенты (хлорамбуцил, мелфалан, нимустин) оказались наиболее активными ингибиторами роста клеток, что было подтверждено in vivo [21].
В большом числе работ продемонстрирована выраженная цитотоксичность нового класса препаратов – ингибиторов полиАДФрибозаполимеразы (PARP) в отношении клеток BRCA-дефицитных опухолей [21,22].
PARP участвует в репарации одноцепочечных разрывов ДНК.
Эффективность ингибиторов фермента при дисфункции BRCA основывается на так называемом феномене синтетической летальности, который предполагает реализацию губительного для клетки эффекта при сочетании двух факторов, каждый из которых по отдельности не приводит к клеточной смерти.
Так, в нормальной клетке при угнетении PARP одноцепочечные разрывы ДНК в процессе репликации конвертируются в двух цепочечные, после чего эффективно репарируются посредством гомологичной рекомбинации.
В то же время в условиях дефицита последней в BRCAассоциированных опухолях происходит летальное накопление дефектов ДНК [22].
Рак молочной железы
В целом ряде клинических работ показана высокая чувствительность BRCA1/2-ассоциированных опухолей молочной железы к стандартным схемам неоадъювантной химиотерапии на основе антрациклинов [23,26], причем в некоторых из них отмечены лучшие результаты у носителей BRCA1 по сравнению с BRCA2 [25].
В то же время в одном исследовании были показаны противоположные результаты: частота полных патологических ответов 17% у носителей мутации против 49% у пациенток со спорадическими опухолями [27].
Наиболее наглядны данные Byrski и соавт., проанализировавших эффективность различных режимов неоадъювантной терапии при BRCA1-ассоциированном раке молочной железы (табл. 1).

Обращает на себя внимание низкая эффективность комбинации доксорубицина и доцетаксела.
Wysocki и соавт. при генетическом анализе 19-ти пациенток, не ответивших на терапию доцетакселом, обнаружили мутацию BRCA1 у 5 (26%) [28].
Kreige и соавт. также показали низкую эффективность доцетаксела при BRCA1-ассоциированном раке молочной железы, но не при спорадических формах или BRCA2-ассоциированных опухолях [29].
Таким образом, целесообразность применения таксанов в терапии опухолей с мутациями BRCA1 представляется сомнительной.
Наибольший интерес представляют клинические данные об эффективности цисплатина при BRCA1-ассоциированном раке молочной железы.
Препарат в рутинной практике практически не применяется при опухолях данной локализации.
В то же время, в работе польских авторов частота полных патоморфологических ответов на фоне неоадъювантной монотерапии цисплатином у носительниц мутации BRCA1 составила 83% (10/12) (табл. 1) [31].
Исследователи в последующем опубликовали данные о высокой эффективности препарата и при метастатическом наследственном раке молочной железы.
Объективные ответы были получены у 16 из 20 пациенток (80%) [32].
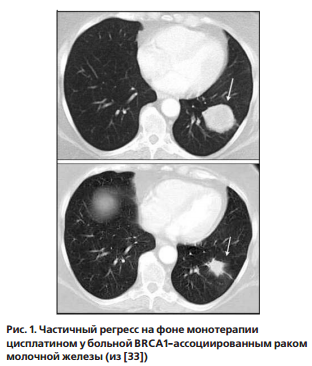
Мы наблюдали выраженный частичный регресс на фоне терапии второй линии цисплатином в монорежиме у пациентки с BRCA1-ассоциированным раком молочной железы после неэффективной терапии с применением комбинации доксорубицина и доцетаксела (рис. 1) [33].
Развитие резистентности к цисплатину при BRCA1 ассоциированном раке может быть связано с возникновением второй мутации в гене, в результате которой восстанавливается рамка считывания и возвращается функциональная полноценность белка [34].
Теоретически можно предположить, что в такой ситуации должна восстановиться чувствительность опухоли к таксанам.
 Учитывая уникально высокую чувствительность BRCA дефицитных опухолей к ДНК-повреждающим агентам, применение интенсивных режимов терапии может оказаться более эффективным за счет быстрого уничтожения клеток и предотвращения развития вторичной резистентности.
Учитывая уникально высокую чувствительность BRCA дефицитных опухолей к ДНК-повреждающим агентам, применение интенсивных режимов терапии может оказаться более эффективным за счет быстрого уничтожения клеток и предотвращения развития вторичной резистентности.
В литературе описано несколько случаев драматических длительных эффектов при проведении высокодозной химиотерапии у больных BRCA-ассоциированным раком молочной железы.
Huang и соавт. описали случай полного регресса диссеминированного рака молочной железы у носительницы мутации BRCA2 на фоне высокодозной химиотерапии [35].
Эффект сохранялся после 11 лет наблюдения.
Vollenberg и соавт. проанализировали данные 40 пациенток, получивших высокодозную химиотерапию по поводу метастатического рака молочной железы [36].
У 6-ти пациенток сохранялся полный регресс на протяжении от 56 до 150 месяцев.
У этих больных были обнаружены хромосомные аберрации, характерные для BRCAассоциированных опухолей.
Кроме того среди них оказались одна пациентка с мутацией BRCA1 и одна с мутацией BRCA2.
Описанные случаи позволяют предположить потенциальную возможность в некоторых случаях даже излечения диссеминированного наследственного рака молочной железы.
В настоящее время активно изучаются ингибиторы PARP, причем, ввиду явного преимущества их именно при BRCAассоциированных опухолях, некоторые исследования включают целенаправленно пациентов с наследственными формами рака.
При BRCA-ассоциированном раке молочной железы у пациенток с прогрессированием после стандартной химиотерапии применение олапариба позволило добиться объективного ответа в 41% и стабилизации в 44% случаев, а выживаемость без прогрессирования составила 5,7 месяцев [37].
В исследовании I фазы ингибитора PARP BMN673 у 18 пациенток с наследственным раком молочной железы наблюдалось 8 объективных эффектов (44%) [38].
Продолжаются исследования и других препаратов данной группы, в том числе в комбинациях с препаратами платины.
Рак яичников
Около 10-15% карцином яичников имеют наследственный характер и возникают у носителей мутаций BRCA1/2.
Кроме того в спорадических опухолях могут встречаться соматические мутации этих генов [39], также наблюдается их инактивация за счет эпигеномных механизмов.
Эти особенности определяют высокую чувствительность опухолей яичников к препаратам платины, которые являются основой стандартных режимов химиотерапии.
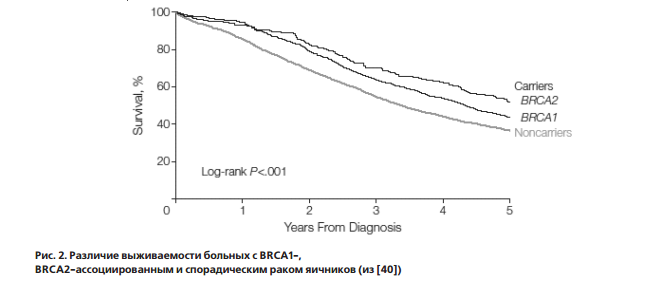
По всей видимости, именно повышенная чувствительность к препаратам платины среди наследственных форм опухолей отражается в преимуществе в выживаемости на фоне стандартной терапии (рис. 2) [40].
Особый интерес представляют работы, показавшие высокую эффективность терапии пегилированным липосомальным доксорубицином при BRCA-ассоциированном раке яичников.
В качестве 2-й или 3-й линии химиотерапии препарат позволил получить объективный эффект у 68% больных с наследственными опухолями и у 49% пациенток со спорадическим раком, а время до прогрессирования составило 15,8 и 8,1 месяцев, соответственно [41].
Adams и соавт. также показали преимущество препарата у носителей BRCA1/2 в частоте объективных ответов (57% против 20%) и выживаемости без прогрессирования (27,1 недель против 17 недель) [42].
Эти данные особенно важны ввиду отсутствия эффективности при BRCA-ассоциированном раке яичников другого препарата, рекомендуемого к применению во 2-й и последующих линиях химиотерапии, топотекана [43].
Достойно внимания сообщение Osher и соавт. о драматическом эффекте терапии мелфаланом – препаратом из группы алкилирующих агентов, у пациентки с BRCA2-ассоциированным метастатическим раком яичников с резистентностью к цисплатину.
Полный регресс у больной продолжался после 25 лет наблюдения [44].
На разных этапах клинического изучения при BRCAассоциированном и спорадическом раке яичников на ходятся несколько ингибиторов РARP.
В ранних фазах исследований у носителей мутаций эти препараты показали высокую эффективность с частотой объективных ответов от 36-46% [38, 45].
Причем, более высокая эффективность препаратов ожидаемо наблюдается при наследственных опухолях по сравнению со спорадическими.
Рак поджелудочной железы
Спорадический РПЖ крайне малочувствителен к лекарственной терапии.
Около 47% семейных форм опухолей этой локализации обусловлены наследственными мутациями BRCA2, BRCA1 и PALB2 (белок, участвующий в гомологичной рекомбинации и взаимодействующий с BRCA2), что определяет их потенциальную чувствительность к терапии препаратами платины и ингибиторам PARP.
Sonnenblick и соавт. описали полный регресс у пациента с BRCA2-ассоциированным раком поджелудочной железы при добавлении цисплатина к терапии гемцитабином, который оказался неэффективным в монорежиме [46].
Lowery и соавт. наблюдали 15 больных раком поджелудочной железы с наследственными мутациями BRCA (BRCA1 – 4 , BRCA2 – 11).
Среди 4-х пациентов, получавших ингибитор PARP в монорежиме или в комбинации с химиотерапией, частичный регресс наблюдался у 3-х.
У 4-го пациента отмечена стабилизация, длившаяся более 6 месяцев.
У 5-ти из 6-ти пациентов, получавших химиотерапию на основе цисплатина, также наблюдался частичный регресс [47].
Опубликованы данные об эффективности олапариба в монорежиме у 23 больных раком поджелудочной железы, включенных в исследование II фазы по изучению эффективности препарата при BRCA-ассоциированных опухолях.
Объективные ответы наблюдались у 21,7% пациентов [48].
Исследования ингибиторов PARP в монорежиме и в комбинациях при наследственных формах рака поджелудочной железы продолжаются.
Другие опухоли
В литературе описаны также отдельные случаи лечения редко встречающихся у носителей мутаций BRCA1/2 опухолей.
Так, известен случай длительного (более 10 лет) эффекта терапии митомицином, цисплатином и винкристином у больного раком легкого с наследственной мутацией BRCA2 [49].
Описаны случаи эффективности олапариба [50] и цисплатина [51] при раке предстательной железы у носителей мутаций BRCA2.
Мы наблюдали двух больных раком желудка с мутациями BRCA1.
В обоих случаях на фоне химиотерапии с включением препаратов платины был зафиксирован частичный регресс, длившийся 10,7 и 21,9 месяцев.
Частота носительства мутаций в исследованной нами группе больных раком желудка составила 3,6% [52].
Семейный аденоматозный полипоз толстой кишки
Семейный аденоматозный полипоз (САП) проявляется образованием множественных полипов толстой кишки, способных к малигнизации.
Классический САП обусловлен наследственной доминантной мутацией гена АРС.
В патогенезе развития полипов при этой патологии участвует циклооксигеназа2, чем определяется эффективность ингибиторов фермента при САП.
В клиническом исследовании прием целекоксиба в дозе 400 мг дважды в день в течение 6 месяцев приводил к редукции числа полипов на 28% и их размеров на 30,7%, на основании чего препарат был одобрен для лечения САП [53].
Однако, ввиду значительного повышения риска сердечносо-судистых осложнений на фоне приема терапевтических доз препарата, в настоящее время ведется поиск альтернативных, более безопасных лекарственных средств с аналогичным механизмом действия.
Наследственный неполипозный рак толстой кишки (ННРТК)
ННРТК, или синдром Линча, связан с носительством мутаций в генах MLH1, MSH2, PMS2 или MSH6 и обусловливает развитие всего 23% опухолей толстой кишки.
Нарушение функции указанных генов приводит к дефекту репарации неспаренных оснований (MMR, mismatch repair) и проявляется на генетическом уровне так называемым высоким уровнем микросателлитной нестабильности (МСН).
Стоит отметить, что МСН является достаточно частым явлением и в спорадических опухолях толстой кишки (около 15%).
Чаще всего опухоли с МСН встречаются у пожилых больных, в то же время опухоли при синдроме Линча развиваются обычно в молодом возрасте.
Так как анализ мутаций представляет собой значительно более сложный и дорогой процесс, на сегодняшний день данные клинических исследований при раке толстой кишки рассматривают как фактор стратификации, именно наличие МСН.
Таким образом, нельзя однозначно утверждать, что все результаты, показанные для опухолей с МСН, справедливы в частности для ННРТК, хотя предполагается, что такое допущение правомерно, учитывая единый характер фенотипических и молекулярных изменений в опухоли [1].
МСН является благоприятным прогностическим фактором.
Несмотря на высоко злокачественную гистологическую картину, опухоли с МСН развиваются индолентно, реже метастазируют.
Это хорошо иллюстрирует снижение частоты МСН в зависимости от стадии процесса: II ст. 22%, III ст. – 12%, IV ст. – 2% [54].
В предклинических работах показана низкая чувствительность клеток с МСН к фторпиримидинам, цисплатину, карбоплатину, но не к оксалиплатину и иринотекану [1].
На основании анализа данных клинических исследований на сегодняшний день отсутствие эффекта фторпиримидинов в адъювантной терапии опухолей толстой кишки с МСН стало очевидным [55].
Более того, показа но негативное влияние 5-фторурацила на безрецидивную выживаемость у больных со II стадией [56].
Причем в одном из исследований проводился анализ выживаемости именно у больных с ННРТК, получавших и не получавших адъювантную терапию фторпиримидинами.
В этой группе различий выявлено не было [57].
Таким об разом, учитывая благоприятный прогноз опухолей с МСН, резистентность их к фторпиримидинам, проведение адъювантной химиотерапии последними при II стадии не рекомендуется.
В то же время при анализе данных в целом негативного исследования III фазы, изучавшего эффективность адъювантной терапии иринотеканом и 5-фторурацилом в сравнении с только 5-фторурацилом, было выявлено некоторое преимущество комбинации при опухолях с МСН [58].
Что касается режимов с включением оксалиплатина, данных пока недостаточно, чтобы уверенно судить о ее эффективности в адъювантной терапии опухолей с МСН.
Данные о предиктивной значимости МСН в отношении эффективности фторпиримидинов, оксалиплатина и иринотекана при распространенном раке толстой кишки ограничены и зачастую противоречивы [1].
Наследственный медуллярный рак щитовидной железы
Медуллярный рак составляет 3% от всех опухолей щитовидной железы.
Причем причиной развития четверти случаев этого заболевания является наследственная мутация в гене тирозинкиназного рецептора RET.
Опухоль может развиваться как единственное проявление наследственного синдрома или как одна из манифестаций синдрома множественных эндокринных неоплазий 2 типа.
Мультикиназный ингибитор вандетаниб продемонстрировал способность специфически блокировать мутированный рецептор RET.
В исследовании у 30-ти пациентов с наследственным медуллярным раком щитовидной железы в 83% случаев было отмечено разной степени уменьшение размеров опухолевых очагов на фоне терапии вандетанибом.
Частота объективных ответов составила 20%, а выживаемость без прогрессирования 27,9 месяцев [59].
Так как и в большинстве случаев спорадического медуллярного рака щитовидной железы обнаруживаются соматические мутации RET, в последующем было проведено исследование, включавшее больных без отбора по признаку наследственного характера опухоли.
83% пациентов, принимавших вандетаниб, прожили 6 месяцев без прогрессирования против 63% больных, принимавших плацебо [60].
На основании этих исследований препарат был одобрен к применению при медуллярном раке щитовидной железы.
Опухоли кожи (базальноклеточные карциномы)
Синдром базальноклеточных невоидных карцином, или синдром Горлина, – это редкое наследственное заболевание, причиной которого является наследственная мутация в гене PTCH.
При отсутствии функционального белка PTCH происходит бесконтрольная активация онкогена SMO, что приводит к развитию множественных базальноклеточных карцином.
Последние чувствительны к терапии висмодегибом – ингибитором белка SMO [61].
В спорадических базальноклеточных карциномах также обнаруживается в большинстве случаев дисфункция PTCH и активация SMO, и, как следствие, висмодегиб эффективен не только при наследственных формах.
Туберозный склероз – ангиомиолипома почек, гигантоклеточная субэпендимальная астроцитома
Туберозный склероз – это наследственное заболевание, обусловленное мутациями в генах TSC1 или TSC2.
Продукты обоих генов являются негативными регулято рамикиназы mTOR – ключевого звена внутриклеточно го сигнального каскада PI3K/Akt/mTOR.
Активация последнего при дисфункции TSC1/2 приводит к пролиферации клеток и неопластическому росту.
Заболевание проявляется развитием множественных доброкачественных опухолей в различных органах, в том числе ангиомиолипомы почек, гигантоклеточной субэпендимальной астроцитомы.
На сегодняшний день появилась возможность патогенетической терапии этих опухолей при помощи ингибиторов mTOR.
В исследовании III фазы при применении эверолимуса наблюдалось уменьшение гигантоклеточных субэпендимальных астроцитом не менее чем на 50% у 35% больных [62] и ангиомиолипом почек у 80% пациентов [63].
Заключение
Наследственные опухоли наблюдаются чаще, чем мы думаем.
Многие из них отличаются от спорадических форм по течению и прогнозу.
Выбор лекарственной терапии для больных наследственными опухолями требует индивидуализированного патогенетически обоснованного подхода и часто может отличаться от стандартов, принятых для спорадических новообразований соответствующих локализаций.
В настоящее время в условиях повышения доступности генетических тестов можно ожидать скорейшего накопления знаний о наследственных опухолях, их специфической чувствительности к лекарственной терапии, что в последующем позволит улучшить результаты лечения как самих наследственных новообразований, так и их спорадических фенокопий.
В.М. Моисеенко, Н.М. Волков
ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)»,
ООО «Лечебно-диагностический центр международного института биологических систем имени Сергея Березина», г. Санкт-Петербург
Журнал "ПРАКТИЧЕСКАЯ ОНКОЛОГИЯ" Т. 15, №3 – 2014
